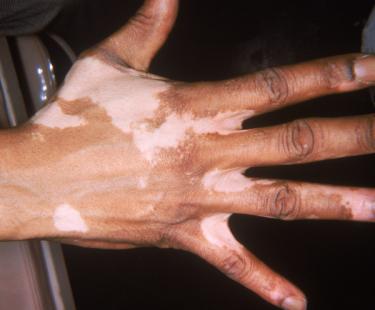
La crème Opzelura (ruxolitinib) a décroché son autorisation de mise sur le marché (AMM) européenne le 19 avril dernier. Une « très grande nouvelle pour les malades », se réjouit l’Association française du vitiligo, même si la date de sa mise à disposition dans les pharmacies françaises n’est pas encore fixée.
Il s’agit du premier traitement de repigmentation dans le vitiligo non-segmentaire chez les adultes et adolescents dès 12 ans. Opzelura 15 mg/g (ruxolitinib) a décroché son AMM européenne le 19 avril après le feu vert accordé en février dernier par l’Agence européenne du médicament (EMA). Très attendu, ce traitement topique est un inhibiteur des Janus kinase (JAK 1 et JAK 2), développé par le laboratoire américain Incyte et déjà autorisé aux États-Unis depuis juillet 2022. « L'approbation d'Opzelura par la Commission européenne constitue un progrès significatif pour les personnes atteintes de vitiligo non-segmentaire avec atteinte du visage et qui, jusqu'à présent, n'avaient pas de traitement médical permettant la repigmentation », souligne Hervé Hoppenot, PDG d'Incyte.
Opzelura se présente en tube de 100 grammes. Il est approuvé pour une utilisation topique deux fois par jour sur les zones dépigmentées, jusqu’à une superficie corporelle maximale de 10 %. L’EMA précise que « le traitement peut être nécessaire pendant plus de six mois afin d’obtenir une repigmentation satisfaisante de la peau » et que ce traitement « n’est délivré que sur ordonnance et (…) doit être instauré et surveillé par un médecin expérimenté dans le diagnostic et le traitement du vitiligo non-segmentaire ».
L’Association française du vitiligo s’est félicitée de cette « très grande nouvelle pour les malades du vitiligo dans toute l’Europe » et notamment de son arrivée « en pharmacie dans les prochains mois ». Elle rappelle cependant qu’il n’est « pas possible d’estimer de date précise » et que le délai moyen entre l’AMM européenne et la mise à disposition en France, « est d’environ 497 jours, soit un peu plus d’un an et 4 mois ». Elle promet de jouer « un rôle déterminant pour accélérer le processus et obtenir le meilleur remboursement possible ».

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %