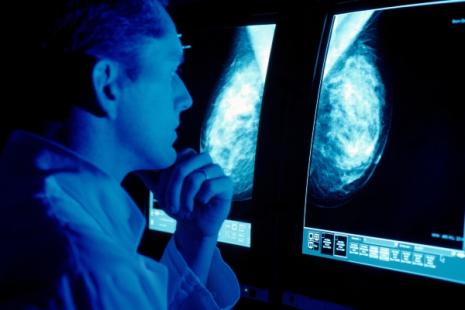
C’est une bonne nouvelle en ce mois d’Octobre rose, dédié au cancer du sein. Trodelvy, traitement du cancer du sein triple négatif autorisé en accès précoce, sera disponible dès le 1er novembre.
« Un nouveau traitement prometteur contre une forme agressive du cancer du sein, dite triple négatif, sera disponible en France à compter du 1er novembre », a annoncé le ministre de la Santé, Olivier Véran, lors d’une séance de questions à l’Assemblée nationale. Le médicament ne disposera pas d’une AMM, mais d’une « autorisation précoce ».
Cette nouvelle option thérapeutique, c’est le Trodelvy (sacituzumab govitecan) 180 mg poudre pour solution à diluer pour perfusion, un traitement par anticorps conjugué à une chimiothérapie fabriqué par Gilead. Trodelvy apporte un gain absolu de 4 mois de survie, selon les études réalisées.
Le ministre souligne que la France a été le premier pays européen à pouvoir en faire bénéficier quelques patientes. En effet, Trodelvy est accessible dans le cadre d’autorisation temporaire d’utilisation nominative (ATU) depuis le 4 novembre 2020 et depuis le 1er juillet 2021 dans le cadre d’une « autorisation d’accès compassionnel ». Dans ce périmètre, il est uniquement destiné aux patientes présentant un cancer du sein triple négatif métastatique ayant précédemment reçu au moins 2 lignes de traitement en situation avancée ou métastatique. Soit un nombre limité d’entre elles.
Pour élargir l’accès au Trodelvy, la Haute Autorité de santé a lancé une évaluation de ce médicament, qui a abouti à l’octroi d’une « autorisation précoce », cette fois-ci pour toutes les patientes ayant un cancer du sein triple négatif ne répondant pas aux traitements actuels (et non plus à un nombre limité d’entre elles).
Cette autorisation précoce a été octroyée en septembre 2021 pour un an, impliquant une mise à disposition du traitement par le laboratoire dans les deux mois. Ce qui sera donc le cas, comme l'a confirmé le ministre de la Santé. Quant à la durée d’un an de cette autorisation, elle « devrait permettre de répondre aux besoins de l’ensemble des patientes concernées en attendant l’aboutissement de la procédure d’obtention d’une autorisation de mise sur le marché », précise la HAS, sachant que la demande d’AMM a été déposée le 3 mars 2021 à l'Agence européenne du médicament (EMA).
Forme particulièrement agressive de la maladie, le cancer du sein triple négatif est le moins fréquent, mais représente environ 15 % des cas, soit quelque 9 000 personnes en France chaque année.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %