Après le renouvellement cellulaire en 2016 et le rythme circadien en 2017, le comité Nobel a récompensé cette année des recherches plus proches de l’application clinique. Les travaux de James Allison et Tasuku Honjo sur l’immunothérapie sont à l’origine d’évolutions récentes et décisives dans la prise en charge des mélanomes et d’autres cancers.
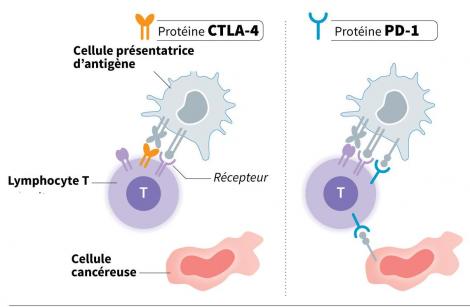
En mettant respectivement au point les anticorps monoclonaux anti CTLA-4 et anti-PD1, l’américain James Allison, titulaire de la chaire du département d’immunologie de l’université du Texas, et le japonais Tasuku Honjo, de l’université de Kyoto, ont en effet créé une nouvelle approche du traitement du cancer : la mobilisation du système immunitaire contre les cellules tumorales. Cette idée avait déjà été proposée une première fois par l’allemand Paul Ehrlich, colauréat du prix Nobel de médecine de 1908. Le Pr James Allison n’hésite d’ailleurs pas à qualifier son travail et celui de Tasuku Honjo de « renaissance de l’immunothérapie ».
Tout commence à Marseille
La découverte du CTLA-4 n’est pourtant pas attribuable à James Allison pour autant. Il faut rendre à César ce qui est à César, voire à Marius ce qui est à Fanny, puisque c’est à Marseille que ce récepteur situé sur les lymphocytes T est mis en évidence pour la première fois en 1987, par l’équipe de Pierre Golstein, du Centre d’immunologie de Marseille-Luminy (CNRS/Inserm/Aix-Marseille Université). « Le rôle de cette molécule n’était pas bien connu au départ, explique Pierre Golstein au « Quotidien », nous nous inscrivions dans une approche qui consistait à identifier de façon systématique les molécules impliquées dans la cytotoxicité. Nous en avions découvert plusieurs, mais la subtilité de CTLA-4 est qu’elle ne faisait pas directement partie du mécanisme de cytotoxicité : elle le régulait. Cela n’a été compris que plus tard. »
Huit ans plus tard, en 1995, 2 équipes américaines découvrent qu’en inactivant sélectivement le gène produisant CTLA-4, les lymphocytes T cytotoxiques sont suractivés. En 1996 l’équipe de James Allison expérimente le premier anticorps anti CTLA-4 et lève pour la première fois, grâce à un traitement, l’inhibition de la réponse immunitaire.
« Les anti-PD1 ont connu le même parcours mais avec 5 ans de décalage », se souvient Pierre Golstein. Le récepteur PD-1 est découvert en 1992 par l’équipe de Tasuku Honjo. Ce dernier tire parti du précédent créé par CTLA-4 et oriente tout de suite ses recherches vers la piste d’un anticorps capable de bloquer les PD-1.
Après les premiers essais chez la souris en 1994, les premières études cliniques de l’anti CTLA-4 sont rapidement entreprises chez l’homme. En 2010, une grande étude de phase 3 montre l’effet de l’ipilimumab dans le mélanome. Les anti PD-1 ont fait leurs premiers pas chez l’animal en 1996, et ont définitivement prouvé leur intérêt dans le mélanome métastatique et dans les cancers bronchiques non à petites cellules en 2012.
Des mécanismes d'action encore méconnus
Les 2 récepteurs n’ont pas encore livré tous leurs secrets. « Tout n’est pas totalement clair quant aux mécanismes qui expliquent leur action, précise Pierre Golstein. CTLA-4 agit vraisemblablement sur l’activation des cellules cytotoxiques et PD1 sur la cytotoxicité elle-même. De plus, si l’on sait qu’ils ne sont pas totalement indépendants l’un de l’autre, ils agissent tout de même de façon différente ce qui permet de les associer pour les potentialiser et obtenir une synergie » (voir l'article« des stratégies à l’essai pour aller plus loin »).
Rien que pour CTLA-4, pas moins de 3 mécanismes d’action sont envisagés pour expliquer la manière dont il exerce une inhibition sur l’activation de la cytotoxicité. Les chercheurs ont encore du pain sur la paillasse.