Dans un essai clinique mené aux États-Unis, le dostarlimab administré chez 12 patients atteints de cancer du rectum a permis d'atteindre une rémission chez tous les sujets traités. Une première dans l'histoire de la lutte contre ce cancer.
Durant cet essai, les chercheurs du Memorial Sloan Kettering cancer center (États-Unis) ont testé l'efficacité du dostarlimab, un anticorps monoclonal, en tant que traitement du cancer du rectum.
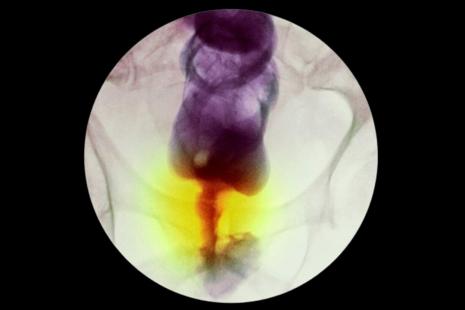
L'essai portait sur 12 patients souffrant d'un cancer du rectum localisé de stade II ou III et dont la tumeur contenait une mutation génétique spécifique (V600E du gène BRAF). Cette dernière est généralement traitée par chimiothérapie et radiothérapie néoadjuvantes suivies d'une résection chirurgicale du rectum.
Les patients ont reçu 500 mg de dostarlimab toutes les 3 semaines pendant 6 mois. Les résultats sont exceptionnels : « Tous ont présenté une réponse clinique complète au dostarlimab, sans aucun signe de tumeur sur l'IRM, l'évaluation endoscopique, le toucher rectal ni sur la biopsie », pointe le rapport. Aucun effet secondaire n'a été rapporté. Enfin, les chercheurs précisent qu'aucun cas de progression ou de récidive de la maladie n'a été signalé au cours du suivi (de 6 à 25 mois selon les patients) et qu'aucun sujet n'a eu besoin, après le traitement par dostarlimab, d'une chimio/radiothérapie ou d'une d'intervention chirurgicale.
Les résultats ont été présentés lors du Congrès du cancer de Chicago organisé par l’Association des cancérologues américains (ASCO) et publiés dans le « New England Journal of Medicine » début juin.
Si les scientifiques se félicitent de ces résultats et appellent à reproduire l'essai, ils reconnaissent que l'étude se concentre sur un nombre très réduit de patients qui présentaient tous une mutation cancéreuse spécifique. Un suivi plus long ainsi que d'autres essais seront donc nécessaires pour confirmer ces résultats.
En France, le dostarlimab est commercialisé sous le nom de Jemperli par GlaxoSmithKline. Il est indiqué dans le traitement du cancer de l’endomètre récidivant ou avancé. En octobre 2021, la Haute Autorité de santé (HAS) avait émis un avis défavorable à son remboursement dans cette indication.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %