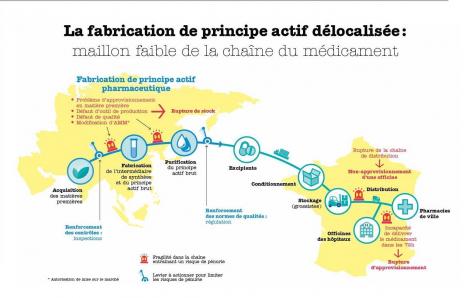
En sept ans, les ruptures de stock de médicaments ont été multipliées par 10, a évalué l’Agence nationale de sécurité du médicament et des produits de santé (ANSM). Rien qu’en 2014, 438 produits ont été déclarés manquants.
Certes, rappelle David Simonnet, vice-président du pôle de compétitivité pharmaceutique Polepharma et P-DG du groupe de chimie fine Axyntis, « ces ruptures sont en partie liées à une augmentation de la demande mondiale, à la pratique du contingentement ou encore à des incidents au niveau de la répartition pharmaceutique, mais c’est surtout la fabrication mondialisée des matières premières qui en est la cause ». De fait, rappelle-t-il, il y a une quinzaine d’années, la pression sur les prix a initié un vaste mouvement de délocalisation de la production de principes actifs (PA). Aujourd’hui, 80 % d’entre eux sont issus des chaînes de fabrication d’usines chinoises ou indiennes.
Une tendance lourde que vient encore accentuer le « grignotage » constant des capacités de production françaises. « Sur les cinq dernières années, nous avons perdu encore 5 à 10 % de nos capacités de production dans l’Hexagone. » Un phénomène qui a deux conséquences, commente David Simonnet : un effet immédiat sur le nombre de PA fabriqués en France, mais aussi, et c’est plus grave, sur le tissu industriel français lui-même. En effet, lorsqu’une ligne de production ferme définitivement, il est ensuite extrêmement compliqué d’envisager sa réouverture, car les processus de qualification de l’outil et du personnel sont longs et coûteux. Et de citer l’exemple éclairant du Tamiflu : « Lors de la crise de la grippe aviaire, les autorités ont demandé aux industriels de relancer une production hexagonale de Tamiflu. Il aurait fallu attendre deux ans avant de voir sortir la première boîte… »
Quelques relocalisations
La France serait-elle en train de perdre cette bataille industrielle ? « Il faut nuancer ce constat, pondère le vice-président de Polepharma, car une autre tendance vient redonner un peu d’espoir. » En effet, depuis 2 ou 3 ans, les écarts de coûts de fabrication entre l’Asie et l’Europe se sont un peu réduits. Parallèlement, les standards des normes environnementales ou de sécurité ont augmenté en Chine et en Inde, ce qui a conduit plusieurs sites de production à fermer. Conséquence ? Certains laboratoires français privés de leur PA n’ont plus été en mesure de distribuer leur médicament et ont décidé de relocaliser la production de la matière première. « Nous n’en sommes pas encore à un rééquilibrage, et nous en sommes loin, mais ce mouvement vers la relocalisation va dans le bon sens, indique David Simonnet. Malheureusement, il s’agit plus d’une démarche défensive que stratégique. » Pour rendre plus stratégique ces relocalisations opérées sous la contrainte, Polepharma pousse un autre argument : le marquage de l’origine de la matière première.
Un pictogramme « made in France »
Le marquage des lieux de fabrication par un pictogramme (notamment du PA), apposé sur les conditionnements, est ainsi l’un des chevaux de bataille de David Simonnet. « Je milite depuis 2011 pour rendre explicite l’origine des lieux de production sur les boîtes de médicament. Dans la droite ligne de la mesure 35 du CSIS* 2013 la France vient d’ailleurs de prendre des initiatives majeures au niveau de la Commission européenne », explique-t-il.
Enfin, une dernière piste pourrait encore légitimer l’essor du « made in France » : l’exemple américain. Les autorités américaines ont adopté une loi, la GDUFA (Generic drug user fee act), qui impose à tout importateur de PA vers les États-Unis de s’acquitter d’un forfait qui vient alimenter les ressources financières de la FDA. Depuis l’entrée en vigueur de cette loi, et grâce à ses subsides, un millier d’inspecteurs supplémentaires ont pu être recrutés. Ce qui permettra à la FDA, à l’horizon 2017, d’opérer une revue complète, tous les deux ans, des 1 500 sites de fabrication de matières premières présents en Asie.
En comparaison, l’ANSM française ne dispose aujourd’hui que de 10 inspecteurs pour contrôler les mêmes 1 500 sites asiatiques. Or il y a bien un problème de qualité de fabrication, souligne David Simonnet, qui rappelle que sur trois inspections opérées en Chine ou en Inde, en moyenne l’une d’elles se solde par le retrait de la certification. Inspiré par cet exemple, l’EFCG (European fine chemicals group) réclame ainsi l’adoption d’une GDFUA à l’européenne. Relocaliser la production, promouvoir le marquage « made in France » et doper les capacités d’inspections des sites étrangers, voilà trois pistes, parmi d’autres, qui pourraient enfin tordre la longue et inflexible courbe des ruptures de stock en France…


Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %