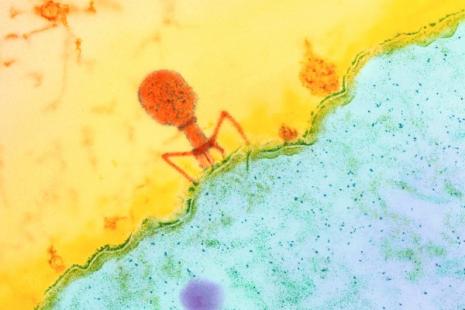
À ce jour, aucun bactériophage ne dispose d’une autorisation de mise sur le marché (AMM) en Europe ou aux États-Unis. Néanmoins, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) vient d’autoriser deux bactériophages en accès compassionnel pour les patients atteints d’infections osseuses et ostéoarticulaires graves en impasse thérapeutique.
La biotech nantaise Pherecydes s’était félicitée, fin mai, de l’obtention de l’autorisation d’accès compassionnel (AAC) pour ses bactériophages contre Staphylococcus aureus. C’est au tour de l’ANSM de détailler les raisons de cette autorisation ainsi que ses conditions. Ainsi, précise l’agence, les deux bactériophages anti-staphylocoque doré concernés, PP1493 et PP1815, doivent être systématiquement utilisés en association, chez les adultes et adolescents atteints d’une infection osseuse ou ostéoarticulaire dont le pronostic vital ou fonctionnel est engagé. Le but ? « Permettre aux patients qui ne peuvent pas participer à un essai clinique d’accéder à la phagothérapie dans un cadre sécurisé », répond l’ANSM.
Des essais cliniques qui se font encore bien rares dans les bactériophages. Mais l’ANSM annonce également qu’elle vient d’autoriser le tout premier, PhagoDAIR I, et que d’autres devraient suivre. « Les essais cliniques et les autorisations d’accès compassionnel peuvent être mis en place car ces bactériophages sont désormais produits et contrôlés selon les standards de qualité équivalents à ceux requis pour tous les médicaments expérimentaux », précise l’agence.
L’utilisation de PP1493 et PP1815 est réservée à l’usage hospitalier et soumise à une procédure de surveillance étroite de la part de l’ANSM par le biais d’un protocole d’utilisation thérapeutique et de recueil de données d’utilisation et de sécurité. Chaque demande de prescription devra être validée par un avis collégial donné par un centre de référence des infections ostéoarticulaires complexes (CRIOAC) qui tiendra compte du résultat d’un phagogramme. La posologie prévue en initiation est d’une à trois administrations. Dans le cas où plusieurs administrations sont prévues, il convient de limiter le délai entre chacune et, si le délai est supérieur à 10 jours, « de re-tester l’activité des solutions de bactériophages ». Un renouvellement peut être envisagé après avis du CRIOAC et après la réalisation d’un nouveau phagogramme afin de vérifier l’activité des bactériophages précédemment administrés.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %