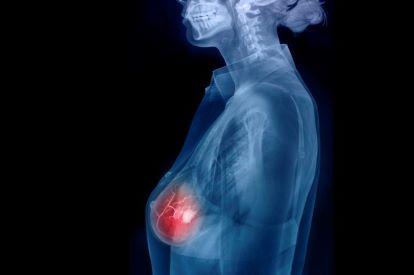
Le Trodelvy est un traitement du cancer du sein triple négatif métastatique pour les patientes qui sont en échec thérapeutique après deux lignes de traitement systémique ou plus. Ne disposant pas encore d’AMM, il vient d’être autorisé en accès précoce, le nouveau système dérogatoire d’accès et de prise en charge des médicaments venant remplacer les ATU et RTU.
En France, le cancer du sein triple négatif est le sous-type de cancer du sein le moins fréquent mais il représente environ 15 % des cas, soit environ 9 000 personnes chaque année. La maladie est mortelle avec une survie globale médiane de 14 mois et demi et un taux de survie à 5 ans de 11,3 %. Les options thérapeutiques pour le traiter sont rares et souvent peu efficaces. Et Trodelvy (sacituzumab govitecan, Laboratoire Gilead) représente une nouvelle option thérapeutique, qui apporte un gain absolu de 4 mois de survie, selon les études réalisées.
Dans ce contexte, la Haute Autorité de santé (HAS) a autorisé le 2 septembre l’accès précoce au Trodelvy pour les personnes chez qui 2 lignes de traitement systémiques ou plus (dont au moins une mise en œuvre au stade avancé de la maladie) n’ont pas fonctionné.
Cette autorisation a été octroyée pour un an, ce qui implique une mise à disposition du traitement par le laboratoire dans les deux mois. « La durée de cette autorisation devrait permettre de répondre aux besoins de l’ensemble des patientes concernées en attendant l’aboutissement de la procédure d’obtention d’une autorisation de mise sur le marché », précise la HAS, sachant que la demande d’AMM a été déposée le 3 mars 2021.
Rappelons que Trodelvy est déjà accessible dans le cadre d’autorisation temporaire d’utilisation nominative (ATU) depuis le 4 novembre 2020 et d’autorisation d’accès compassionnel depuis le 1er juillet 2021, pour un nombre limité de patientes présentant un cancer du sein triple négatif métastatique ayant précédemment reçu au moins 2 lignes de traitement en situation avancée ou métastatique. Mais ces dispositions ne suffisent pas à couvrir les besoins de toutes les patientes.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %