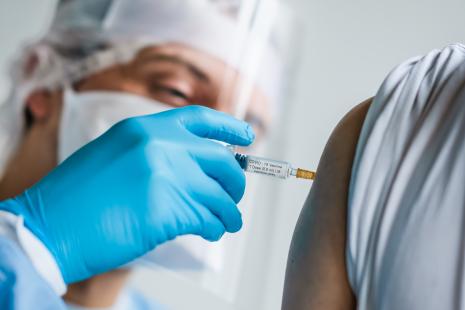
La publication confirme le profil d'innocuité du vaccin et son efficacité contre la maladie, alors qu'aucun cas grave de Covid-19 n'a été rapporté dans le groupe des volontaires vaccinés.
Les données de sécurité de ce vaccin reposent sur l'analyse de quatre essais menés au Royaume-Uni, au Brésil et en Afrique du Sud, sur un total de 23 745 volontaires entre le 23 avril et le 4 novembre. Quant aux résultats d'efficacité, ils s'appuient sur une analyse groupée de deux essais de phase 3, incluant 11 636 participants, dont 7 548 au Royaume-Uni (essai COV002) et 4 088 au Brésil (essai COV003). Le suivi médian était de 3,4 mois, équivalant à 74 341 personnes-mois après la première dose, et de deux mois équivalant à 29 060 personnes-mois après deux doses.
Deux schémas de doses étudiés
Dans cette analyse intermédiaire, les participants, tous majeurs, avaient principalement entre 18 et 55 ans (86,7 % d'entre eux au Royaume-Uni et 89,9 % au Brésil). Recrutés plus tardivement, les 56 ans et plus représentaient 12,2 % des cas.
Les volontaires ont été randomisés selon un ratio 1:1 en deux groupes, l'un recevant le candidat vaccin (voie intramusculaire), le second (groupe contrôle) un vaccin méningococcique conjugué des groupes A, C, W et Y ou une solution saline.
Tous les volontaires du groupe AZD1222 ont reçu deux doses standards de vaccin, à l'exception d'un sous-groupe au Royaume-Uni ayant reçu une demi-dose suivie d'une dose standard. Le délai entre deux doses était variable.
Le critère de jugement principal était la survenue d'au moins un symptôme évocateur de Covid (fièvre ≥ 37,8 °C, toux, essoufflement, anosmie ou agueusie) chez une personne ayant un test RT-PCR positif au-delà de 14 jours après la deuxième injection.
Conformément aux résultats déjà communiqués par le laboratoire, l'efficacité globale du vaccin était de 70,4 %. Sur l'ensemble des participants, 131 personnes ont développé une forme symptomatique de Covid, répondant au critère de l'étude : 30 dans le bras vacciné (soit 0,5 %) et 101 dans le bras contrôle (soit 1,7 %).
Une efficacité chez les personnes âgées non avérée
« Cinq cas inclus dans l'analyse primaire sont survenus chez des participants âgés de plus de 55 ans. L'efficacité du vaccin dans les groupes d'âge plus âgés n'a pas pu être évaluée, mais sera déterminée, si des données suffisantes sont disponibles, dans une analyse future une fois que d'autres cas auront été enregistrés », précisent les auteurs.
En prenant en compte uniquement les participants ayant reçu deux doses standards, l'efficacité est de 62,1 %, avec des résultats similaires entre le Royaume-Uni et le Brésil (respectivement 60,3 et 64,2 %). Des analyses en sous-groupes n’ont pas non plus montré de différence d'efficacité en comparant les intervalles entre les doses courts et longs (< 6 semaines versus ≥ 6 semaines).
Le schéma une demi-dose suivie d'une dose standard était associé à une efficacité étonnamment élevée de 90 %. Si ce phénomène a déjà été observé pour des vaccins infantiles, des études complémentaires sont nécessaires pour en déterminer les mécanismes immunitaires.
Par ailleurs, « des données supplémentaires seront nécessaires pour déterminer la durée de la protection vaccinale et la nécessité de doses de rappel », précisent les auteurs.
Des événements indésirables graves ont été rapportés chez 168 participants, 79 du groupe vaccin et 89 du groupe contrôle. Sur les 175 événements signalés, trois ont été considérés comme possiblement liés au vaccin expérimental ou au vaccin contrôle.
Aucun cas grave dans le groupe vacciné
Vingt et un jours après la première dose vaccinale, dix participants ont été hospitalisés pour Covid-19, dont un est décédé. Aucun n'avait reçu le candidat vaccin.
Le vaccin AZD1222 peut être conservé entre 2 et 8 °C, « ce qui le rend particulièrement adapté à une distribution mondiale », estiment les auteurs. Il s'agit d'un vaccin à vecteur adénoviral non réplicatif (adénovirus de chimpanzé) contenant le gène codant pour la protéine Spike (S) du SARS-CoV-2. Le vaccin Spoutnik V de l'institut russe Gamaleya est basé sur cette même approche, mais avec des vecteurs recombinants d'adénovirus humains, tandis que les vaccins de Pfizer/BioNTech et de Moderna sont des vaccins à ARN. Tous ont annoncé une efficacité supérieure à 90 %.
Par ailleurs, les Émirats arabes unis ont approuvé, le 9 décembre, le vaccin du groupe chinois Sinopharm, dont l'efficacité annoncée est de 86 %, rapporte l'AFP.

Du 23 au 31 décembre
Menace d’une nouvelle fermeture des laboratoires d’analyses médicales
Addictions
La consommation de drogues et d’alcool en baisse chez les jeunes
Crise sanitaire : le malaise des préparateurs
3 questions à…
Christelle Degrelle