Dans ces recommandations sur l’étiquetage des médicaments, l’ANSM privilégie clairement la dénomination commune à la marque du produit. Une mesure visant à renforcer la sécurité du patient.
Après avoir publié ses recommandations sur les noms de médicaments, particulièrement sur l’usage des marques ombrelles, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM), édite un deuxième volet de recommandations destinées cette fois à « l’étiquetage des conditionnements des médicaments sous forme orale solide ».
Il s’agit toujours de réduire les risques d’erreur médicamenteuse et de favoriser le bon usage du médicament. Cette fois, c’est par une standardisation du conditionnement, une uniformisation des codes couleurs et typographiques et surtout par une mise en avant de la dénomination commune (DC) que l’ANSM compte faciliter l’identification du médicament, améliorer le support de l’administration et mieux prévenir les erreurs.
Ces mesures prises à la suite d’une série de consultations avec l’ensemble des acteurs prévoient ainsi que « la ou les dénominations communes (DC) doivent être mises en exergue » (jusqu’à 3). Un ensemble d'éléments graphique (taille de police minimale de 22 points, choix de couleurs contrastant sur le fond du conditionnement, éléments graphiques…) doit contribuer à mettre en évidence la DC et le dosage. La ou les DC doivent être inscrites dans le premier champ de lecture, en haut à gauche sur chaque face avant du conditionnement ainsi que sur la face arrière, la face latérale N° 2 et le rabat de fermeture N° 1.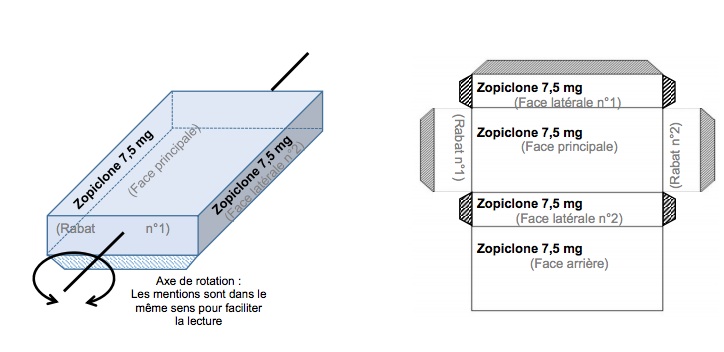
Lorsque le nom du médicament est composé de la DC assortie d'une marque ou du nom de laboratoire, ces derniers doivent être apposés sur la même ligne, à la suite de la DC. Cependant, lorsque le nom du médicament est un nom de fantaisie, celui-ci est préférablement mentionné au-dessus de la DC. Des espaces suffisants doivent par ailleurs être réservés afin que le pharmacien puisse inscrire la posologie prescrite, le nom du princeps à la suite de la mention « médicament générique de… » et enfin des conseils utiles au bon usage.
 De même, si le médicament l'exige, des surfaces doivent être dédiées aux pictogrammes. Il conviendra de respecter les pictogrammes d'usage (automobile, femme enceinte, Info-Tri-médicament…) en évitant des pictogrammes ou des dessins à caractère promotionnel ou rappelant fruits, personnages, jouets et même plantes. D'autres standardisations visent le libellé des informations au patient, toujours à rédiger sur une forme affirmative et sans abréviation. Enfin, une série de recommandations est adaptée aux conditionnements primaires sous forme de blisters, de sachets, de flacons ou de tubes.
De même, si le médicament l'exige, des surfaces doivent être dédiées aux pictogrammes. Il conviendra de respecter les pictogrammes d'usage (automobile, femme enceinte, Info-Tri-médicament…) en évitant des pictogrammes ou des dessins à caractère promotionnel ou rappelant fruits, personnages, jouets et même plantes. D'autres standardisations visent le libellé des informations au patient, toujours à rédiger sur une forme affirmative et sans abréviation. Enfin, une série de recommandations est adaptée aux conditionnements primaires sous forme de blisters, de sachets, de flacons ou de tubes.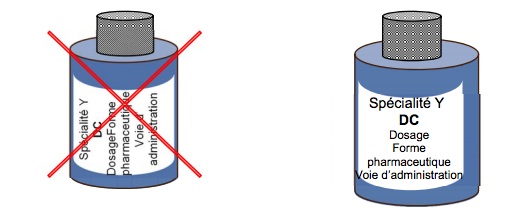


Insolite
Épiler ou pas ?
La Pharmacie du Marché
Un comportement suspect
La Pharmacie du Marché
Le temps de la solidarité
Insolite
Rouge à lèvres d'occasion